O diagrama de fases de uma substância pura permite avaliar o estado físico de uma amostra em função da pressão e da temperatura a que está submetida.
Diagrama de Fases da Água
O gráfico mostra a relação da pressão e temperatura, com o estado físico da substância, observamos que a uma pressão constante e com aumento ou diminuirmos a temperatura ocorre a mudança de estado físico, (solido para liquido, líquido para vapor e sólido para vapor). O mesmo ocorre se a temperatura constante, aumentamos ou diminuirmos a pressão.
O ponto de ebulição da água aumenta a medida que aumentamos a pressão. Por isso em lugares com maiores altitudes, onde a pressão é menor, a água ferve a temperatura menor que 100°C.
📌Nota:
A água também pode entrar em ebulição na temperatura ambiente , para isso colocamos a água em um recipiente fechado conectado com uma bomba de vácuo, que diminuirá a pressão interna, fazendo a água entrar em ebulição.
Pressão de Vapor de um Líquido
Pressão de vapor de um líquido é a pressão exercida por seus vapores, quando estão em equilíbrio dinâmico com o líquido.LEMBRAR:
A pressão de vapor de um líquido, a uma dada temperatura, não depende das quantidades de líquido e de vapor presentes.
Imagine que em vários frascos iguais de, colocamos quantidades diferentes de água e que todos foram fechados e mantidos a mesma temperatura. Haverá evaporação do líquido, a concentração de vapor irá aumentar até que, se estabeleça um equilíbrio entre as fases vapor e líquido.
Uma vez estabelecido este equilíbrio apesar do volume das fases ser diferente nos frascos, a pressão de vapor será o mesma.
Se contudo, a quantidade de líquido inicial colocado não for suficiente para a quantidade de vapor formado atinja a pressão de vapor, que permite que se estabeleça um equilíbrio, então todo o líquido terá evaporado sem que se atinja um equilíbrio, e sem haver este equilíbrio, a pressão interna de vapor é menor que à pressão de vapor do líquido.
Mesmo que o frasco tenha tamanho e formato diferentes a pressão de vapor será igual em todos eles desde que tenha líquido o suficiente para que se estabeleça equilíbrio.
.
📌Nota:
Para que uma bolha de vapor possa se formar, crescer e escapar do líquido é fundamental que a pressão de um vapor que, a forma seja superior ou igual a pressão que a atmosfera faz sobre o líquido caso contrário, a ebulição não ocorrerá, pois a bolha será "esmagada" pela pressão atmosférica.
A temperatura de ebulição de um líquido é aquele em que a pressão de vapor se iguala a pressão atmosférica. (Pv = Patm). A 25°C, a pressão de vapor da água é 23,8 mmHg. Se diminuirmos a pressão externa de 760 mmHg para 23,8 mmHg, a água entrará em ebulição nesta temperatura.
Pressão de Vapor de Líquidos de Diferentes
Líquidos diferentes na mesma temperatura apresentam pressão de vapor diferente.
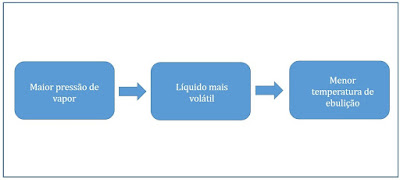
O líquido com maior pressão de vapor, numa dada temperatura, é o que se apresenta nesta temperatura maior tendência a evaporar. Ao comparar líquidos, dizemos que aquele que apresentar maior pressão de vapor é mais volátil.
Moléculas de água ligam se umas as outras através de ligação de hidrogênio, assim como as moléculas do álcool, porém, em menor quantidade, as moléculas de acetona por sua vez, estão ligadas entre si por dipolos mais fracos que a ligação de hidrogênio. Portanto a acetona evapora mias facilmente, e sua pressão de vapor é maior que o álcool e a água.
Fonte:
Bibliografia:
Química na abordagem do cotidiano, volume único/ Francisco Miragaia Peruzzo(Tito) Eduardo Leite do Canto (Canto) _ 2 ed. _ São Paulo: Moderna, 2002.
Universo da Química: ensino médio: volume único/José Carlos de Azambuja Bianchi, Carlos Henrique Albrecht, Daltamir Justino Maia - 1.ed. - São Paulo:FTD, 2005.
Química / Ricardo Feltre. -- 3. ed. -- São Paulo: Moderna, 1988. v. 2. Físico química.







Nenhum comentário :
Postar um comentário